Giorgio Bedogni 1,2, Athos Borghi 2 e Nino Battistini 1
1 Cattedra di Nutrizione Umana, Dipartimento di Scienze Biomediche, Università di Modena.
2 Dipartimento di Medicina Interna, Università di Modena.
Modelli bicompartimentali
Lo studio della composizione corporea comporta la suddivisione del corpo umano in due o più compartimenti (fig. 1) (1).

Figura 1
Modelli bi- e penta-compartimentale del corpo umano (le dimensioni dei compartimenti corporei sono quelle dell’uomo di riferimento). Abbreviazioni: BW = body weight; FFM = fat-free mass; FM = fat mass; TBW = total body water; PM = protein mass; MM = mineral mass; Gn = glycogen (40).
I modelli bicompartimentali considerano il peso corporeo (BW, body weight) come la somma della massa grassa (FM, fat mass; 15% di BW nell’uomo di riferimento) e della massa “priva di grassi” o “magra” (FFM, fat-free mass; 85% di BW):
![]()
La stima della FM o della FFM da un modello bicompartimentale presuppone la costanza di una caratteristica della massa magra: densità (1.1 kg / L), contenuto di acqua (0.73) o contenuto di potassio (68.1 mEq / kg). Le tecniche di valutazione che si basano su tali assunzioni sono la densitometria corporea, l’idrometria e la misurazione del potassio 40.
Modelli multicompartimentali
La crescita, l’invecchiamento e la malattia modificano la composizione della FFM cosicché i valori di riferimento per la densità, l’idratazione e il contenuto di potassio, ricavati dallo studio di cadaveri di soggetti adulti, non possono essere utilizzati nel bambino, nell’anziano e nell’ammalato. Per avere una stima attendibile della FFM in queste condizioni, è necessario l’impiego di modelli multicompartimentali, il più noto dei quali (cfr. fig. 1) considera la FFM come la risultante della sommatoria di acqua (TBW, total body water; 73% di FFM), proteine (PM, protein mass; 20% di FFM), minerali (MM, mineral mass; 6% di FFM) e glicogeno (Gn, glycogen; 1% di FFM):
![]()
sicché (cfr. eq. 1):
![]()
che rappresenta il modello pentacompartimentale della composizione corporea.
Il modello pentacompartimentale
Nel modello a 5 compartimenti (eq. 3), BW rappresenta la somma di cinque specie molecolari: l’acqua, le proteine, i lipidi, i carboidrati e i minerali. (Le vitamine non vengono considerate in quanto presenti in quantità trascurabile; in virtù del loro ruolo funzionale, contrapposto a quello energetico e strutturale, esse verranno considerate nell’ambito della funzionalità corporea.) Per questa ragione, il modello a 5 compartimenti è anche detto "molecolare". Il modello molecolare dà rilievo alla relazione esistente tra la dieta e lo stato di salute: all’acqua e a ogni nutriente (con l’eccezione delle vitamine) corrisponde un compartimento corporeo.
Acqua totale corporea
L’acqua è il costituente principale del corpo umano. Essa rappresenta il 60% di BW e il 73% della FFM nell’uomo di riferimento (fig. 1). Due terzi dell’acqua della FFM sono intracellulari (ICW, intracellular water; 40% di BW) e il restante terzo è extracellulare (ECW, extracellular water; 20% di BW) (fig. 2).

Figura 2
I compartimenti idrici nell’uomo di riferimento (BW, body weight = 70 kg). Abbreviazioni: TBW = total body water, ECW = extracellular water, ICW = intracellular water, IW = interstitial water, BlW = blood water, TCW = transcellular water; LW = lymphatic water (4).
Utilizzando il principio di diluizione (v. idrometria), l’ECW viene comunemente misurata utilizzando come indicatore il bromuro (Br). Questo viene somministrato per os (in genere come sale sodico) e dosato nel plasma o nelle urine con metodica HPLC (2, 3). L’ECW viene calcolata dallo spazio di diluizione del Br utilizzando la formula:
![]()
ovvero, correggendo lo spazio di diluizione del Br (DS, dilution space) per la sua distribuzione “non-extracellulare” e per l’effetto Donnan, rispettivamente. L’ICW viene calcolata dalla differenza:
L’ECW comprende l’acqua interstiziale (IW, interstitial water; 14% di BW), plasmatica (BlW, blood water; 4% di BW), linfatica (LW, lymphatic water; 1% di BW) e transcellulare (TCW, transcellular water; 1% di BW). Delle componenti di ECW, soltanto BlW può essere valutata direttamente, attraverso la diluizione del blu di Evans o dell’albumina marcata con 131I (il principio utilizzato è sempre quello di diluizione).
BlW assicura il nutrimento alle cellule dell’organismo: i suoi scambi con ICW sono regolati da IW; LW coadiuva BlW allontanando i prodotti del catabolismo cellulare. TCW rappresenta la somma di numerosi compartimenti idrici, in collegamento sia con il plasma che con lo spazio interstiziale: i più rilevanti sono il liquido intraoculare, quello sinoviale, quello cerebrospinale e il liquido contenuto nel lume intestinale. Anche i liquidi pleurico, pericardico e peritoneale fanno parte di TCW: essi vanno ricordati perché si espandono in diverse condizioni cliniche (4). In condizioni fisiologiche, ICW è un indicatore della "massa metabolicamente attiva" dell’organismo (4, 5). L’acqua è infatti il costituente principale della cellula e le modificazioni del volume idrico intervengono nella regolazione del metabolismo cellulare (6).
Massa proteica
La massa proteica, che rappresenta il 17% di BW e il 20% della FFM nell’uomo di riferimento (cfr. fig. 1), viene calcolata dall’azoto totale corporeo (TBN, total body nitrogen) misurato attraverso l’attivazione neutronica (IVNAA, in vivo neutron-activated analysis). Gli atomi di azoto (e di altri elementi) possono essere infatti identificati in base alla radiazione gamma emessa a seguito di un bombardamento neutronico. Una volta misurato TBN, si calcola PM dall’eq.:
![]()
che assume un rapporto fisso (1:16) tra l’azoto e la massa proteica. A differenza delle assunzioni fatte dai modelli bicompartimentali, questa si fonda su una relazione chimica ed ha perciò maggior validità (1).
Dei compartimenti definiti dall’eq. (3), la PM è quello con il maggior significato metabolico. Ciò dipende dal ruolo assunto dalle proteine nell’ambito dell’economia cellulare: oltre a rivestire una funzione strutturale (ed energetica), esse regolano la sua attività funzionale, specialmente sotto forma di enzimi.
Massa minerale
La massa minerale rappresenta il 5% di BW e il 6% della FFM nell’uomo di riferimento (cfr. fig. 1). Essa comprende una massa ossea (Mo) e una massa extra-ossea (Me), che rappresentano rispettivamente l’88 e il 12% di MM. Mo viene misurata attraverso l’assorbiometria a doppio raggio X (DXA, dual-energy X-ray absorptiometry). In base all’attenuazione differenziale di raggi X di due differenti energie, la DXA è infatti in grado di discriminare i tessuti ossei da quelli non-ossei (7). Per ottenere una valutazione accurata dei minerali che compongono Me, è necessario l’impiego della IVNAA. Essa consente attualmente di misurare il contenuto corporeo dei seguenti elementi: calcio, sodio, cloro, fosforo, azoto, idrogeno, ossigeno e carbonio (8).
Nonostante i minerali rappresentino soltanto il 6% della FFM, la maggioranza di essi svolge funzioni indispensabili per la vita, intervenendo nella regolazione dei fluidi extra- ed intra-cellulari, partecipando come cofattori all’attività di numerosi enzimi e svolgendo una funzione “strutturale” (ad es., il calcio nelle ossa).
Glicogeno
Il glicogeno è una componente labile della FFM, essendo una fonte di energia di rapido impiego. Calcolato per differenza, Gn rappresenta l’1% di BW e FFM nell’uomo di riferimento (cfr. fig. 1). La sua valutazione in vivo è oggi possibile attraverso la spettroscopia in risonanza magnetica ma questa tecnica non ha ancora trovato un impiego negli studi di composizione corporea per via della labilità intrinseca di questo compartimento (9).
Massa grassa
FM viene usualmente calcolata per differenza (cfr. eq. 3):
![]()
dove il termine Gn è spesso ignorato per i motivi di cui si è detto. La misurazione del carbonio totale corporeo (TBC, total body carbon) fornisce un metodo più diretto (e preciso) per la stima della FM (10).
Accrescimento, invecchiamento e composizione corporea
Le modificazioni qualitative della composizione corporea che hanno luogo nel corso della vita sono simili nei due sessi. A parità di età, comunque, la composizione corporea della donna differisce da quella dell’uomo da un punto di vista quantitativo. Nel corso dell’accrescimento, la donna presenta un maggior sviluppo della FM e, soprattutto, una maturazione più lenta di tutte le componenti della FFM rispetto all’uomo. Ciò è illustrato nelle fig. 3 e 4 per il periodo compreso tra la nascita e l’età di 10 anni e nella fig. 5 per l’età da 10 a 18 anni (11, 12).

Figura 3
Modificazioni della massa grassa standardizzata sul peso corporeo (FM% = FM / BW) dalla nascita all’età di 10 anni. I valori sono espressi come percentuale del peso corporeo. I punti neri indicano soggetti di sesso maschile, quelli bianchi soggetti di sesso femminile. I grafici sono stati ottenuti dai dati tabulati da Fomon (12).
Figura 4
La composizione della massa magra dalla nascita all’età di 10 anni. Abbreviazioni: TBW = total body water; ICW = intracellular water; ECW = extracellular water; PM = protein mass; MM = mineral mass. I valori sono espressi come percentuale della massa magra. I punti neri indicano soggetti di sesso maschile, quelli bianchi soggetti di sesso femminile. I grafici sono stati ottenuti dai dati tabulati da Fomon (12).
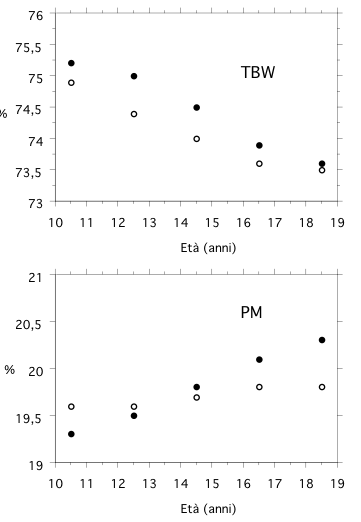
Figura 5
Modificazioni delle componenti acquosa e proteica della massa magra da 10 a 18 anni di età. Abbreviazioni: TBW = total body water; PM = protein mass. I valori sono espressi come percentuale della FFM. I punti neri indicano soggetti di sesso maschile, quelli bianchi soggetti di sesso femminile. I grafici sono stati ottenuti dai dati tabulati da Hascke (11).
Nel corso dell’accrescimento, l’idratazione della FFM (FFMH, fat-free mass hydration) decresce progressivamente sino a raggiungere il valore “adulto” del 73% (cfr. fig. 4 e 5). All’età di due anni, l’acqua intracellulare della FFM inizia a prevalere su quella extracellulare, fungendo da indicatore dei processi di crescita e sviluppo cellulare (cfr. fig. 4). Pochi dati sono disponibili sull’idratazione e sulla distribuzione dell’acqua corporea in età geriatrica: studi effettuati con modelli multicompartimentali suggeriscono che FFMH non si modifichi nell’anziano mentre sono oggetto di controversia le modificazioni degli spazi intra- ed extra-cellulare. PM presenta un incremento rilevante dall’età di 2 anni, sino a raggiungere un valore “adulto” del 20% (cfr. fig. 4 e 5). MM presenta un decremento progressivo dall’età di 30-40 anni: raggiunto il cosiddetto “valore di picco” (6% della FFM), essa inizia a contrarsi e tale contrazione è più rilevante nella donna.
Malattia e composizione corporea
Per quanto ogni malattia rappresenti un’entità a sé stante dal punto di vista dei suoi effetti sulla composizione corporea, è opportuno formulare alcune “regole” generali, utili per affrontare lo studio clinico della composizione corporea.
Innanzitutto, una malattia in grado di favorire un bilancio energetico a lungo negativo, porterà a una contrazione della FM. In passato, si riteneva che la contrazione della PM, anch’essa a fini energetici, seguisse sempre quella della FM. Sulla base di studi recenti, quest’idea è stata abbandonata: diverse malattie si caratterizzano per una contrazione della PM contemporanea a quella della FM (13).
La contrazione di MM, e di Mo in particolare, è caratteristica dell’osteoporosi ma è comune a molte malattie croniche che non coinvolgono direttamente l’osso (14).
Più complesse sono le modificazioni di TBW, ECW e ICW che s’instaurano con la malattia (4). Le modificazioni di ECW sono spesso clinicamente evidenti: ad es., la presenza di edema denuncia l’espansione di ECW% (ECW/BW) e l’emoconcentrazione può essere riconducibile a una diminuzione di BlW e, quindi, di ECW%. Al contrario, le modificazioni di ICW% (ICW/BW) non sono clinicamente evidenti anche se sono quelle più importanti perché coinvolgono direttamente la cellula. L’espansione di ICW% è comune a molte malattie ed è spesso riconducibile a un difetto di attività delle pompe ioniche di membrana (15). La contrazione di ICW% segnala anch’essa uno stato di sofferenza cellulare, spesso determinato da fattori osmotici (passaggio di acqua dal versante intra- a quello extra-cellulare).
Magrezza e obesità
La magrezza e l’obesità sono caratterizzate rispettivamente da un difetto e da un eccesso di FM. Entrambe si associano a importanti modificazioni della FFM. Una riduzione prolungata dell’assunzione dei nutrienti porta infatti a una contrazione della PM, a un’espansione dell’ECW% e a una riduzione della MM (16); un aumento prolungato dell’assunzione dei nutrienti porta invece a un’espansione assoluta di tutte le componenti della FFM e di ECW% (3, 17-19).
La valutazione della composizione corporea nella pratica clinica
L’invasività, la complessità e il costo delle metodiche utilizzate rendono impossibile l’impiego routinario dei modelli multicompartimentali per determinare i compartimenti corporei nella pratica clinica. Ciononostante, è possibile utilizzare in alcuni casi equazioni predittive per la valutazione della composizione corporea. Molti indicatori della composizione corporea possono essere comunque utilizzati nella pratica clinica indipendentemente dalla possibilità di fornire predizioni di compartimenti corporei.
Valutazione antropometrica dello stato nutrizionale
Peso, statura e indici pondero-staturali
La misurazione di BW e della statura (BH, body height) è una pratica clinica consolidata. Essa permette una valutazione dello stato nutrizionale del paziente attraverso il confronto con una popolazione di riferimento. BW e BH dovrebbero essere comunque combinati per fornire i cosiddetti indici pondero-staturali (20). Tali indici sono stati studiati per presentare la miglior correlazione con la FM e il più noto di essi è l’indice di massa corporea (BMI, body mass index):

In senso stretto, un valore di BMI inferiore al 5.0° percentile designa una condizione di magrezza e uno superiore al 95.0° percentile una condizione di obesità. Per ottenere la miglior informazione possibile, il BMI dovrebbe essere standardizzato per età e sesso, specialmente nel bambino e nell’anziano. La Tab. 1 riporta i valori assoluti di BMI per la diagnosi del difetto e dell’eccesso ponderale nell’uomo e nella donna adulti

Tabella 1
Valori assoluti di BMI per la diagnosi del difetto e dell’eccesso ponderale nell’uomo e nella donna adulti (25).
Nell’adulto, il BMI è un indicatore del rischio di malattia associata all’eccesso ponderale (21). Nonostante sia stato messo a punto come predittore della FM, il BMI non fornisce alcuna indicazione effettiva sulla composizione corporea del soggetto. Per quanto l’osservazione clinica debba sempre confortare la diagnosi di magrezza o sovrappeso suggerita dal BMI, essa dovrebbe essere integrata dall’impiego di indicatori diretti di adiposità e muscolarità. Ciò è reso possibile dalla misurazione delle pliche e delle circonferenze (22).
Pliche
Le pliche (tab. 2) possono essere utilizzate: 1) come tali, per stabilire il grado di adiposità-magrezza; 2) unitamente alle circonferenze, per calcolare le aree muscolo-adipose degli arti (v. oltre); 3) come indicatori del rischio di malattia (il loro valore predittivo è però inferiore a quello delle circonferenze); 4) all’interno di equazioni predittive della FM. Quest’ultima applicazione si basa sull’evidenza di una correlazione tra lo spessore del tessuto adiposo sottocutaneo e la FM, tale da rendere possibile la predizione di quest’ultima dalle pliche.

Tabella 2
Le pliche più frequentemente utilizzate per la valutazione della composizione corporea (22).
Circonferenze
Le circonferenze permettono una valutazione della distribuzione del tessuto adiposo sottocutaneo (tab. 3). Esse possono essere utilizzate: 1) unitamente alle pliche, per il calcolo delle aree muscolo-adipose degli arti (v. oltre); 2) come indicatori del rischio di malattia; 3) all’interno di equazioni predittive della FM (v. sopra).

Tabella 3
Le circonferenze più frequentemente utilizzate per la valutazione della composizione corporea (22).
Come si è detto, alcune circonferenze corporee sono predittori del rischio di malattia. In particolare, il rapporto tra la circonferenza della vita (WC, waist circumference) e quella dei fianchi (HC, hip circumference), detto WHR (waist-hip ratio), è un indicatore di primaria importanza:

Si ritiene che il valore predittivo del WHR dipenda dalla correlazione esistente tra la distribuzione del tessuto adiposo sottocutaneo e quella del tessuto adiposo viscerale (24) (fig. 6). É noto infatti che la distribuzione del tessuto adiposo viscerale è un fattore di rischio più importante della quantità assoluta di tessuto adiposo, viscerale o corporeo. In particolare, valori di WHR superiori a 0.85 nella donna e a 1.0 nell’uomo si associano a diverse complicanze dell’obesità (25). In studi recenti, WC si è dimostrato un predittore delle complicanze dell’obesità ugualmente affidabile o superiore a WHR. Poiché WC richiede una sola misurazione rispetto alle due necessarie per il calcolo di WHR, in futuro esso potrebbe sostituire quest’ultimo nel calcolo del rischio di malattia del soggetto obeso. WHR presenta peraltro il vantaggio che il suo denominatore, HC, include informazioni importanti sulla massa muscolare gluteo-femorale e sulla struttura ossea (25).

Figura 6
Effetti metabolici dell’accumulo di grasso viscerale. Abbreviazioni: FFA = acidi grassi liberi (free fatty acids); VLDL = lipoproteine a bassissima densità (very low density lipoproteins); HDL = high density lipoproteins. Modificata da Bjorntorp (24).
Aree muscolo-adipose degli arti
Le aree muscolo-adipose degli arti vengono calcolate da una plica e dalla circonferenza corrispondente, assumendo che l’arto abbia una sezione circolare (26). Le aree muscolare (AMA, arm muscle area) e adiposa (AFA, arm fat area) del braccio, per le quali sono disponibili valori di riferimento, vengono calcolate dalla plica tricipitale e dalla circonferenza del braccio (inserto 6).
Analisi dell’impedenza bioelettrica
L’analisi dell’impedenza bioelettrica (BIA, bioelectric impedance analysis) consente la predizione non invasiva della TBW e dell’ECW (27-29). Essa si basa sul principio per cui l’impedenza (Z) del corpo umano a una corrente alternata (c.a.) è inversamente proporzionale al suo contenuto di acqua ed elettroliti. Somministrata a basse frequenze (≤ 5 kHz), la c.a. percorre in prevalenza i fluidi extracellulari mentre a frequenze più elevate (≥ 100 kHz), supera le membrane cellulari penetrando i fluidi intracellulari.
Nella sua applicazione “a tutto corpo”, la BIA prevede la somministrazione di una c.a. di 800 μA attraverso elettrodi sistemati sulla superficie dorsale della mano e del piede ai metacarpi e metatarsi distali rispettivamente. Elettrodi sensori sistemati tra le prominenze distali del radio e dell’ulna e tra il malleolo mediale e laterale della caviglia, consentono di registrare l’impedenza del corpo alla c.a.
Le formule predittive dei compartimenti idrici presentano generalmente la seguente struttura:

dove V è il volume del distretto corporeo (TBW, ECW), Ht l’altezza dell’individuo e Zf l’impedenza alla frequenza f. Il rapporto Ht2/Z (o ZIf) rappresenta l’indice di impedenza” alla frequenza e deriva dall’approssimazione del corpo umano a un cilindro di altezza Ht. Esiste anche una variante segmentale della BIA, utile per lo studio della composizione degli arti. La BIA è virtualmente sempre accurata a livello di popolazione ma è spesso inaccurata a livello del singolo individuo.
Assorbiometria a doppio raggio-X
Come si è accennato discutendo della massa minerale, la DXA è la tecnica di riferimento per la valutazione della massa ossea. Mentre è relativamente facile differenziare i tessuti ossei da quelli molli in base ai valori di attenuazione differenziale di raggi X di due differenti energie, non è possibile utilizzare lo stesso principio per operare la distinzione tra tessuti molli “grassi” e “magri (non-ossei)” (30, 31). Pertanto, la DXA non è (ancora) adeguata per lo studio della composizione corporea. Ciononostante, è auspicabile che il miglioramento della metodica possa rendere disponibile una tecnica per la stima dei tessuti molli nella pratica clinica.
Tecniche per immagine
La tomografia computerizzata (CT, computed tomography) e la risonanza magnetica per immagini (MRI, magnetic resonance imaging) sono utili per lo studio della distribuzione del tessuto adiposo (v. sopra) e della composizione degli arti (32). L’alto costo associato all’impiego di queste metodiche limita il loro impiego a casi selezionati e per lo più a scopo di ricerca.
Conclusione
Lo studio della composizione corporea è necessario per un inquadramento adeguato dello stato nutrizionale e dello stato di salute, essendo inoltre di ausilio nella comprensione dei meccanismi che regolano molti eventi fisiologici e fisiopatologici. Sul versante clinico, esso è necessario per un approccio razionale ai problemi nutrizionali del paziente.
Bibliografia
1. Wang ZM, Heshka S, Pierson RN, Heymsfield SB. Systematic organization of body composition methodology: an overview with emphasis on component-based methods. Am. J. Clin. Nutr. 1995;61:457-65.
2. Wong WW, Sheng HP, Morkeberg JC, Kosanovich JL, Clarke LL, Klein PD. Measurement of extracellular water volume by bromide ion chromatography. Am. J. Clin. Nutr. 1989;50:1290-5.
3. Battistini N, Severi S, Brambilla P, Virgili F, Manzoni P, Beccaria L, et al. Relative expansion of extracellular water in obese vs non obese children. J. Appl. Physiol. 1995;79:94-6.
4. Bedogni G, Borghi A, Battistini N. The assessment of body hydration and water distribution in health and disease. Clin. Diet. 1996;21:3-8.
5. Heymsfield SB, Dwight M. Body composition: research and clinical advances - 1993 A.S.P.E.N. research workshop. J.P.E.N. 1994;18:91-103.
6. Haussinger D, Roth E, Lang F, Gerok W. Cellular hydration state: an important determinant of catabolism in health and disease. Lancet 1993;341:1330-2.
7. Pietrobelli A, Formica C, Wang ZM, Heymsfield SB. Dual-energy X-ray absorptiometry body composition model: review of physical concepts. American Journal of Physiology (Endocrinol. Metab. 34) 1996;271:E941-E51.
8. Ryde SJS. In vivo neutron activated analysis: past, present and future. In: Davies PSW, Cole TJ, editors. Body composition techniques in health and disease. Cambridge: Cambridge University Press; 1995. p. 14-38.
9. Taylor R, Price TB, Rothman DL, Shulman RG, Shulman GI. Validation of 13C NMR measurement of human skeletal muscle glycogen by direct biochemical assay of needle biopsy samples. Magnetic Resonance in Medicine 1992;27:13-20.
10. Kehayas JJ, Heymsfield SB, LoMonte AF, Wang J, Pierson R. In vivo determination of body fat by measuring total body carbon. Am. J. Clin. Nutr. 1991;53:1339-44.
11. Hascke F. Body composition of adolescent males. Part I: total body water in normal adolescent males. Acta Ped. Scand. 1983;Suppl. 307:1-23.
12. Fomon SJ, Haschke F, Ziegler EE, Nelson S. Body composition of reference children from birth to age 10 years. Am. J. Clin. Nutr. 1982;35:1169-75.
13. Jeejeebhoy KN. Body composition in weight loss and pathological states. In: Roche AF, Heymsfield SB, Lohman TG, editors. Human body composition. Champaign, IL: Human Kinetics; 1996. p. 275-83.
14. Christiansen C. Osteoporosis: diagnosis and management today and tomorrow. Bone 1995;17 (Suppl. 5):513S-6S.
15. Borghi A, Bedogni G, Rocchi E, Severi S, Farina F, Battistini N. Multifrequency bioelectric impedance measurements for predicting body water compartments in patients with non-ascitic liver cirrhosis. Br. J. Nutr. 1996;76:325-32.
16. Shetty PS. Body composition in malnutrition. In: Davies PSW, Cole TJ, editors. Body composition techniques in health and disease. Cambridge, UK: Cambridge University Press; 1995. p. 71-84.
17. Forbes GB. The companionship of lean and fat. In: Ellis JK, Eastman JD, editors. Human body composition. In vivo methods, models and assessment. NY: Plenum Press; 1993. p. 1-12.
18. Waki M, Kral J, Mazariegos M, Wang J, Pierson RN, Heymsfield SB. Relative expansion of extracellular fluid in obese vs non obese women. Am. J. Physiol. (Endocrinol. Metab) 1991;261:E199-203.
19. Bedogni G, Bollea MR, Severi S, Trunfio O, Manzieri AM, Battistini N. The prediction of total body water and extracellular water from bioelectric impedance in obese children. Eur. J. Clin. Nutr. 1997;51:129-33.
20. Cole TJ. Weight-stature indices to measure underweight, overweight and obesity. In: Himes JH, editor. Anthropometric assessment of nutritional status. NY: Wiley-Liss; 1991. p. 83-111.
21. Seidell JC. Relationships of total and regional body composition to morbidity and mortality. In: Roche AF, Heymsfield SB, Lohman TG, editors. Human body composition. Champaign, IL: Human Kinetics; 1996. p. 345-51.
22. Battistini N, Bedogni G, editors. Manuale di riferimento per la standardizzazione antropometrica (edizione italiana). Milano: EDRA; 1992.
23. Durnin J, Womerseley J. Body fat assessed from total body density and its estimation from skinfold thickness: measurements on 481 men and women aged from 16 to 72 years. Br. J. Nutr. 1974;32:77-97.
24. Bjorntorp P. "Portal" adipose tissue as a generator of risk factors for cardiovascular disease and diabetes. Arteriosclerosis 1990;10:493-6.
25. WHO. Obesity: preventing and managing the global epidemic. Geneva; 1998.
26. Frisancho A. Anthropometric Standards for the Assessment of Growth and Nutritional Status. Ann Arbor: The University of Michigan Press; 1990.
27. Battistini N, Bedogni G, editors. Impedenza bioelettrica e composizione corporea. Milano: EDRA; 1998.
28. Deurenberg P. International consensus conference on impedance in body composition. Age Nutr. 1994;5:142-5.
29. NIH. NIH Technology assessment conference on bioelectrical impedance analysis in body composition measurement. Bethesda: NIH; 1994.
30. Roubenoff R, Kehayas JJ, Dawson-Hughes B, Heymsfield SB. Use of dual-energy x-ray absorptiometry in body composition studies: not yet a gold standard. Am. J. Clin. Nutr. 1993;58:689-91.
31. Pietrobelli A, Wang ZM, Formica C, Heymsfield SB. Dual-energy X-ray absorptiometry: fat estimation errors due to variation in soft tissue hydration. American Journal of Physiology (Endocrinol. Metab.) 1998;37:E808-E16.
32. Despres JP, Ross R, Lemieux R. Imaging techniques applied to the measurement of human body composition. In: Roche AF, Heymsfield SB, Lohman TG, editors. Human body composition. Champaign, IL: Human Kinetics; 1996. p. 149-66.
33. Brozek J, Grande F, Anderson JT, Keys A. Densitometric analysis of body composition: revision of some quantitative assumptions. Ann. NY. Acad. Sci. 1963;110:113-40.
34. Fidanza F, Keys A, Anderson JT. Density of body fat in man and other mammals. J. Appl. Physiol. 1953;6:252-6.
35. Comizio R, Pietrobelli A, Xiu Tan Y, Wang Z, Withers RT, Heymsfield SB, et al. Total body lipid and trygliceride response to energy deficit: relevance to body composition models. Am. J. Physiol. (Endocrinol. Metab) 1998;37:E860-E6.
36. Lukaski HC, Johnson PE. A simple inexpensive method of determining total body water using a tracer dose of deuterium oxide and infrared absorption of biological fluids. Am. J. Clin. Nutr. 1985;41:363-70.
37. Pace N, Rathbun EN. Studies on body composition, III: The body water and chemically combined nitrogen content in relation to fat content. J. Biol. Chem. 1945;158:685-91.
38. Wang ZM, Pierson RJ, Heymsfield SB. The five-level model: a new approach to organizing body composition research. Am. J. Clin. Nutr. 1992;56:19-28.
39. Lohman TG. Advances in body composition assessment. Champaign, IL: Human Kinetics; 1992.
40. Bedogni G, Battistini N, Severi S, Borghi A. The physiological bases of the assessment of nutritional status. Clin. Diet. 1996;23:141-6.